-
김광명 교수 연구팀, Advanced Materials 학술지에 자가조립 펩타이드 기반 PROTAC 나노입자 (NanoTACs)를 이용한 야생형 및 변이 EGFR 표적 분해 치료 전략 발표 EGFR (상피세포 성장인자 수용체) 표적 치료제인 단일클론항체 (mAbs)와 타이로신 키나아제 억제제 (TKIs)는 암 치료에 널리 쓰이고 있으나, 약물 내성 (L858R/T790M 변이 등) 및 피부 발진과 같은 비표적 독성으로 인해 치료 효과에 한계가 있다. 또한, 기존의 저분자 화합물 기반 PROTAC (표적 단백질 분해 기술)은 낮은 세포 투과도와 종양 선택성 부족, 복잡한 합성과정 등의 문제로 임상 적용에 어려움을 겪어왔다. 이를 극복하고자 연구팀은 EGFR 결합 펩타이드 (EHGAMEI), 자가조립 펩타이드 링커 (FF), 그리고 E3 리가아제 결합 펩타이드 (ALAPYIP)로 구성된 자가조립 펩타이드 유도 PROTAC 나노입자 (NanoTACs)를 개발하였다. NanoTACs는 수용액 상에서 소수성 상호작용과 π-π stacking을 통해 약 144nm 크기의 균일한 구형 나노입자로 자가조립되며, 혈중 안정성을 유지한다. 특히 NanoTACs는 암세포에 유입된 후 '리소좀에 의한 직접 분해'와 리소좀 탈출 후 E3 리가아제에 의한 '프로테아좀 매개 분해'라는 이중 분해 기전을 통해 Wild-type뿐만 아니라 Mutant EGFR까지 효과적으로 제거하도록 설계되었다. 대장암(CT26) 및 내성 폐암(H1975) 마우스 모델에서 NanoTACs는 EPR 효과와 능동적 표적화를 통해 단분자 펩타이드 대비 2.24배 높은 종양 축적 효율을 보였으며, 종양 성장을 88.3% 억제하는 강력한 항암 효과를 입증하였다. 또한, NanoTACs는 기존 항체 치료제의 한계인 수용체 Recycling 기전을 차단하고, TKI 내성을 유발하는 돌연변이 EGFR까지 분해함으로써 약물 내성을 효과적으로 극복하였다. 동시에 정상 조직에 대한 독성은 나타나지 않아 높은 생체 안전성을 확인하였다. 본 연구는 자가조립 펩타이드 기반의 NanoTACs가 암세포의 Wild-type 및 Mutant EGFR을 동시에 표적하여 분해할 수 있는 강력한 플랫폼임을 증명하였으며, 기존 EGFR 표적 치료제의 내성 및 독성 한계를 극복할 수 있는 새로운 치료 전략을 제시하였다. 해당 연구 성과는 재료 분야의 세계적 권위지인 'Advanced Materials' 2025년 최신호에 게재되었다.
- 작성자약학대학 관리자
- 작성일2025.12.17
- 조회수360
-
김광명 교수 연구팀, Advanced Healthcare Materials 학술지에 cathepsin B 절단 독소루비신 프로드럭 나노입자를 이용한 종양특이 면역치료 전략 발표 독소루비신(DOX)은 강력한 면역원성 세포사멸(immunogenic cell death, ICD)을 유도하지만, 낮은 종양 선택성과 심장, 면역기관 독성으로 인해 고용량 투여 및 면역관문억제제와의 병용에 한계가 있다. 기존 나노약물전달체는 EPR 효과를 이용해 종양 축적을 높이려는 시도가 이루어졌으나, 실제 종양 축적률과 약물 봉입률이 낮아 정상조직 독성과 면역세포 소실을 충분히 줄이지 못한다. 이를 극복하고자 연구팀은 cathepsin B에 의해 선택적으로 절단되는 펩타이드(FRRG, FRRL, FRRLL, FRRLG, FRRGLL)를 DOX에 결합한 self-assembling 프로드럭 나노입자를 개발하였고, 입자형성 및 종양 축적이 가장 우수한 FRRL-DOX (CatB-NPs)를 최적 제형으로 도축하였다. CatB-NPs는 별도의 운반체 없이 자가조립되어 혈중에서는 안정하게 유지되다가, cathepsin B가 과발현된 종양 미세환경에서만 단계적으로 분해되며 DOX를 방출함으로써, 암세포에서는 핵 내 축적과 강한 세포사멸, ICD를 유도하고, 심근세포 및 수지상세포, T세포 등 정상세포와 면역세포에서는 독성을 크게 감소시키는 종양특이적 작용을 보인다. CT26 종양 마우스 모델에서 CatB-NPs는 free DOX 대비 혈중 체류와 종양 내 축적이 증가하고, 종양 성장 억제, ICD 지표 증가, 성숙 수지상세포와 CD8+ T세포 활성 증가를 동시에 달성하였다. 특히 anti-PD-L1 항체와 병용 시 종양 완전관해와 재도전 모델에서의 면역기억 형성이 관찰되었으며, 심장 및 비장 독성, 면역세포 감소는 현저히 줄어들었다. 본 연구는 cathepsin B 절단 펩타이드에 기반한 self-assembling DOX 프로드럭 나노입자가 암세포 특이적 ICD 유도와 면역세포 보존을 동시에 달성함으로써, 기존 DOX 기반 chemo-immunotherapy의 독성 한계를 극복할 수 있는 유망한 치료 플랫폼임을 제시하였으며, 관련 성과는 2025년 Advanced Healthcare Materials에 게재되었다.
- 작성자약학대학 관리자
- 작성일2025.12.08
- 조회수270
-
김광명 교수 연구팀, Advanced Drug Delivery Reviews 학술지에 초음파 감응 나노소재 기반 가스 전달 시스템의 최신 동향 논문 발표 종양 미세환경의 저산소증과 면역 억제성은 방사선·화학·면역치료의 효과를 떨어뜨리는 핵심 요인으로, 이를 극복하기 위한 산소(O2), 일산화질소(NO), 일산화탄소(CO), 이산화탄소(CO2), 황화수소(H2S) 등 치료용 가스 기반 전략이 주목받고 있다. 그러나 가스의 높은 확산성, 짧은 체류 시간, 전신 부작용 때문에 임상 적용에는 여전히 한계가 크다. 본 리뷰 논문은 이러한 문제를 해결하기 위한 대안으로, 초음파(ultrasound)를 자극원으로 활용하는 나노소재 기반 가스 전달 시스템(ultrasound-triggered gas delivery systems, UTGDS)의 설계 원리와 응용 현황을 체계적으로 정리하였다. 김광명 교수 연구팀은 초음파 조사 시 발생하는 cavitation, sonoporation, 열 효과를 이용해 가스 방출의 시간, 공간적 제어를 달성하는 전략을 중심으로, 지질 기반 마이크로버블 및 echogenic liposome, mesoporous/hollow silica 및 CaCO3, BaTiO3 등 무기 나노입자, PLGA 및 탄산 고분자 나노입자, 알부민, 페리틴, 가스 베지클 등 단백질 나노구조체, PFC 에멀전 및 MOF, 하이브리드 나노입자 등 다양한 플랫폼을 분류·비교하였다. 각 시스템의 가스 적재 방식, 초음파 조건, 영상화 가능성, 화학, 면역, 방사선, 광치료와의 병용 전략을 통합적으로 정리한 점이 특징이다. 또한 본 리뷰는 UTGDS의 임상 번역을 가로막는 과제로, 가스, 나노소재, 초음파 장치가 결합된 복합 시스템의 안전성 평가, 재현성 있는 대량 생산과 품질 관리, 종양 미세환경 이질성에 따른 맞춤형 설계, 장기 체내 잔류 및 분해산물 독성 검증 등을 제시한다. 본 논문은 초음파 감응 가스 전달 나노시스템이 종양 저산소증 극복과 약물 침투 향상, 영상-유도 정밀 치료를 동시에 달성할 수 있는 유망 플랫폼이며, 향후 난치성 고형암 치료의 새로운 패러다임을 제시할 수 있음을 강조한다.
- 작성자약학대학 관리자
- 작성일2025.12.08
- 조회수280
-
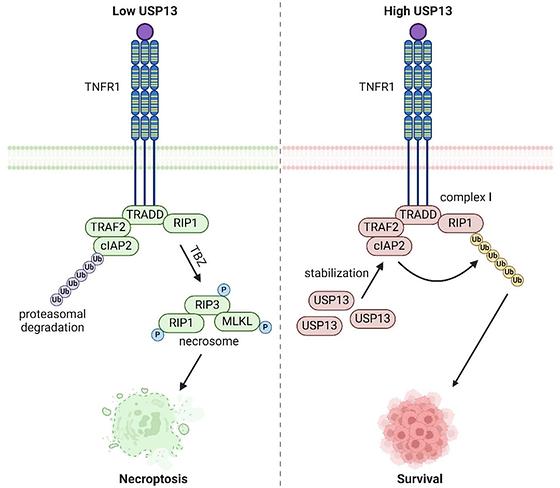
송은주 교수팀, 난치성 대장암의 치료 내성 해결할 핵심 단백질 발견 송은주 약학과 USP13- cIAP2 분해 조절 기전 규명… 새로운 항암표적 제시 국제 저명 학술지 Cell Death & Differentiation 게재 약학과 송은주 교수 연구팀이 기존 항암제에 반응하지 않던 난치성 대장암의 ‘세포 괴사 저항성’을 뒤집는 핵심 분자 기전을 규명하며 새로운 항암치료 전략을 제시했다. 이번 연구 성과는 생화학 및 분자생물학 분야 상위 2.5% 국제 저명 학술지 에 10월 22일(수) 온라인 게재됐다. 연구팀은 대장암 세포가 치료에도 살아남는 원인을 찾기 위해 세포 내 단백질 안정성을 조절하는 탈유비퀴틴화 효소 USP13의 역할에 주목했다. 그 결과, USP13이 세포사멸 억제 단백질인 cIAP2의 분해를 막아 대장암 세포 생존을 돕는 방패 역할을 한다는 사실을 밝혀냈다. USP13이 제거되면 cIAP2 단백질이 빠르게 분해되어 암세포가 네크롭토시스(necroptosis, 프로그램된 괴사성 세포사멸)에 더 취약해지며 기존 항암제의 효과 또한 크게 증폭되는 것으로 확인됐다. 이는 USP13이 대장암 세포의 생존을 매개하는 핵심 조절 인자임을 보여주는 중요한 발견이다. 대장암에서 USP13-cIAP2 축이 항암제 내성 및 세포 생존에 작용하는 분자 기전 모식도 연구팀은 임상 환자 데이터 분석에서도 USP13 발현이 높은 환자일수록 예후가 나쁘고 생존율이 낮아짐을 확인했다. 반대로 USP13을 억제한 세포와 동물 모델에서는 암 세포 성장이 급격히 감소하고, 항암제와의 병용 효과가 극대화됐다. 이러한 결과를 바탕으로 송은주 교수팀은 USP13을 직접적으로 억제하거나 cIAP2 단백질의 안정화를 방해하는 전략이, 기존 치료에 반응하지 않던 난치성 대장암 환자를 위한 새로운 맞춤형 치료 접근법이 될 수 있음을 제시했다. 송은주 교수는 “이번 연구는 암세포의 생존 신호를 정밀하게 조절하는 새로운 분자 기전을 규명함으로써, 치료 저항성 대장암의 한계를 극복할 수 있는 혁신적 치료 표적을 제시했다는 데 큰 의의가 있다”고 밝혔다. 이번 성과는 본교의 기초의학·생명과학 융합연구 역량이 국제적으로 인정받은 사례로, 암세포의 생존 기전을 분자 수준에서 규명한 점에서 학문적·임상적 파급력이 크다. 연구진은 향후 USP13 억제제 후보물질을 개발해, 난치성 대장암 환자 치료의 새로운 돌파구를 마련할 계획이다. 송은주 교수(교신저자), 김연정 박사(제1저자) 본 연구는 한국연구재단 중견연구자지원사업과 BK21 첨단바이오소재 인재양성 교육연구단, 교내 전임인력지원사업의 지원을 받아 진행되었으며, 실험에는 교육부 및 한국기초과학지원연구원(국가연구시설장비센터)의 지원으로 설립된 이화 신약개발연구코어센터의 첨단 연구장비가 활용되었다. 논문 바로 가기: https://www.nature.com/articles/s41418-025-01595-4
- 작성자약학대학 관리자
- 작성일2025.11.13
- 조회수423
-
- 작성자약학대학 관리자
- 작성일2025.11.04
- 조회수402
-
김광명 교수 연구팀, Advanced Healthcare Materials에 고용량 췌장암 치료용 리포좀 플랫폼 연구 발표 김광명 교수(이화여자대학교 약학과) 연구팀이 고용량 화학요법의 독성과 내성 문제를 동시에 해결할 수 있는 신개념 항암 리포좀 플랫폼을 개발하여, 국제학술지 Advanced Healthcare Materials에 연구 성과를 발표했다. 연구팀은 세포사멸을 억제하는 단백질(IAPs)의 발현이 높아 고용량 항암제에도 잘 반응하지 않는 췌장암에서, SMAC 모방 펩타이드와 독소루비신(DOX)을 결합한 프로드럭(SMAC-P-FRRL-DOX)을 설계하고, 이를 cathepsin B에 의해 종양 특이적으로 활성화되는 리포좀(Aposomes)으로 제형화하였다. 이 제형은 기존 리포좀과 달리, 고용량 정맥투여를 전제로 설계되었으며, 종양 내에서는 강력한 세포사멸을 유도하고, 정상 조직에서는 독성을 최소화하는 구조적 특성을 갖는다. KPC960 종양 모델 및 humanized NSG 마우스를 활용한 전임상 실험에서, Aposomes는 반복 고용량 투여에도 심장, 비장 등 주요 장기에서의 독성이 나타나지 않았으며, 종양 내에서만 선택적으로 활성화되어 우수한 종양 억제 효과를 보였다.특히, 기존 DOX에서 문제로 지적되던 심장 독성과 면역세포 억제 문제를 효과적으로 회피한 점에서 임상 전환 가능성이 높은 고용량 항암 플랫폼으로 주목받고 있다. 본 연구는 췌장암과 같은 고저항성 암종에서 고용량 치료의 구조적 한계를 극복할 수 있는 새로운 설계 전략을 제시한 것으로, 향후 다양한 항암제와의 적용 확장을 통해 고용량 화학요법의 치료 지수를 개선하는 정밀 약물전달 기술로의 발전이 기대된다.
- 작성자약학대학 관리자
- 작성일2025.08.05
- 조회수966
-
김광명 교수 연구팀, Acta Pharmaceutica Sinica B학술지에에 광활성화 PROTAC 나노입자를 이용한 뇌종양 면역치료 전략 발표 최근 뇌종양 치료 분야에서는 종양 미세환경 내 면역 억제성을 극복하고 면역치료 반응을 유도하기 위해 다양한 접근이 시도되고 있으나, 여전히 면역관문억제제의 낮은 반응률과 면역세포 탈진, 그리고 약물의 혈관-뇌 장벽(BBB) 통과 한계 등이 임상 적용에 큰 제약으로 작용하고 있다. 이러한 한계를 극복하고자, 김광명 교수 연구팀은 광감각제와 PTP1B 표적 PROTAC을 cathepsin B 절단 펩타이드로 연결한 자가조립형 나노입자(PNPTP1B)를 개발하였다. 이 시스템은 기존의 운반체 없이도 π-π stacking을 통해 자발적으로 나노입자를 형성하며, 광역학치료와 단백질 분해 기전을 동시에 유도할 수 있도록 설계되었다. PNPTP1B는 뇌종양 진행 과정에서 BBB가 붕괴된 영역에 특이적으로 축적되고, cathepsin B에 의해 광감각제와 활성화된 PROTAC으로 효소적 분해된다. 이후 레이저 조사 시 광감각제에 의해 생성된 ROS와 PROTAC에 의한 PTP1B 분해가 시너지 작용을 일으켜, 면역원성 세포사멸을 유도하고, T 세포의 PD-1, Tim3 발현 억제를 통해 탈진을 회복시킨다. 그 결과, 골수 유래 수지상세포의 성숙과 종양 특이 T 세포의 증식 및 활성화가 촉진되어 종양 내 강력한 면역반응을 유도하였다. 본 연구 결과는 2025년 Acta Pharmaceutica Sinica B에 게재되었으며, 마우스 GBM 모델에서의 PNPTP1B 정맥 투여 후 약물의 종양 특이적 축적, T세포 재활성화, 완전관해, 재도전 모델에서의 면역기억 유도 등이 확인되었다. 특히 정위적 뇌종양 모델에서도 광역학치료와 병합된 PNPTP1B가 종양 축소, CD8⁺ T세포 침윤 증가, 탈진 마커 감소 등 우수한 치료효과를 보였고, 정상 조직에 대한 독성은 관찰되지 않았다. 이 연구는 광역학 치료와 PROTAC 기반 단백질 분해 기전을 통합한 혁신적인 치료 플랫폼을 제시하였으며, BBB 통과가 가능한 나노조립체를 활용한 정밀 면역치료 가능성을 입증한 중요한 성과로 평가된다. 향후 광전달 장치와의 결합을 통해 뇌종양을 포함한 난치성 암 치료의 새로운 패러다임을 제시할 수 있을 것으로 기대된다.
- 작성자약학대학 관리자
- 작성일2025.07.22
- 조회수943
-
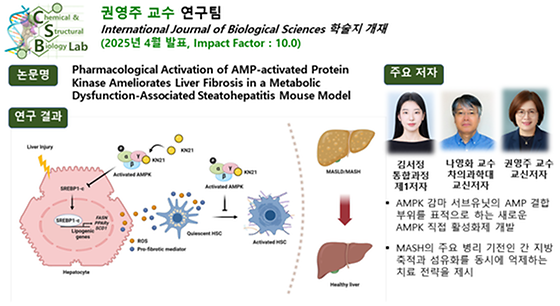
권영주 교수팀, IJBS 학술지에 간 섬유화 치료를 위한 신규 AMPK 직접 활성화제 발굴 연구 게재 약학과 권영주 교수 연구팀이 간 섬유화 치료를 목표로 하는 새로운 직접 AMPK 활성화제를 발굴하였으며, 이를 기반으로 치료 전략을 제시하였다. 본 연구는 국제 저명 학술지 에 최근 게재됐다. 현재 MASH 환자 수가 증가함에 따라, 간 섬유화 진행을 억제할 수 있는 치료제 개발이 시급하다. 2023년 미국 FDA는 MASH 치료제로서 resmetirom을 최초 승인하였으나, 여전히 대다수 환자에게 적용 가능한 치료제는 부족한 실정이다. 권 교수 연구팀은 이와 같은 의료적 미충족 수요를 해소하고자, 새로운 직접 AMPK 활성화제 ‘KN21’을 개발하였다. 분석 결과, KN21은 AMPK 감마 서브유닛의 AMP 결합 부위에 선택적으로 결합하여 AMPK를 직접 활성화하며, 기존 AMPK 활성화제 대비 우수한 효능을 나타내었다. 이러한 AMPK 활성 효과는 MASH 동물모델을 통해 간 지방 축적 억제 및 섬유화 개선으로 이어짐이 입증되었다. 연구팀은 자체 개발한 AMPK 활성화제 ‘KN21’을 활용하여, 간세포에서의 지방 축적을 억제함으로써 지방 독성에 의해 유도되는 섬유화 유도인자의 분비를 감소시키고, 이에 따라 간성상세포의 간접적 활성화를 억제함을 확인하였다. 또한, KN21은 간성상세포에 직접 작용하여 섬유화 관련 마커의 발현을 감소시키는 효과도 입증되었다. 이러한 이중 작용은 MASH 병리의 주요 특징인 지방간과 섬유화를 동시에 개선할 수 있는 치료 전략으로서의 가능성을 제시한다. 이번 연구는 AMPK 감마 서브유닛의 AMP 결합 부위를 표적으로 하는 새로운 AMPK 직접 활성화제를 자체 개발하고, 이를 통해 MASH의 주요 병리 기전인 간 지방 축적과 섬유화를 동시에 억제하는 치료 전략을 제시하였다는 점에서 의의가 크다. 이러한 결과는 MASH를 포함한 다양한 대사성 간질환에 핵심적인 기반 자료로 활용될 수 있으며, 학문적 토대를 마련했다는 점에서 그 의의와 우수성이 높이 평가된다. 본 연구는 한국연구재단의 STEAM 과제와 중견연구자지원사업의 지원을 받아 권영주 교수팀(첨단바이오·소재 인재 양성 교육연구단)을 비롯해 차의과학대학교 나영화 교수 공동 연구진과의 협업을 통해 수행됐으며, 실험에는 교육부와 한국기초과학지원연구원(국가연구시설장비센터)의 연구비 지원을 받아 설립된 이화 신약개발연구코어센터의 연구장비가 활용됐다.
- 작성자약학대학 관리자
- 작성일2025.07.07
- 조회수1132
-
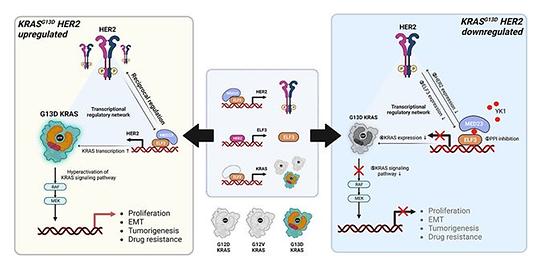
권영주 교수팀 대장암 겨냥한 정밀 치료 타깃 발굴 약학과 권영주 교수 연구팀이 기존 항암 치료에 반응하지 않던 KRASG13D 변이 대장암에서 암세포의 생존과 증식을 매개하는 핵심 신호 경로를 세계 최초로 규명하고, 이를 겨냥한 새로운 맞춤형 치료 전략을 제시했다. 본 연구는 국제 저명 학술지 에 최근 게재됐으며, 기존 치료에 효과가 없었던 대장암 환자들에게 새로운 희망을 줄 것으로 기대된다. 현재 대장암 환자의 최대 80%는 EGFR 단백질이 과도하게 만들어지는 현상을 보이며, 이에 따라 EGFR을 억제하는 세툭시맙(Cetuximab)이 1차 치료제로 사용되고 있다. 그러나 KRAS나 BRAF 유전자에 변이가 있는 환자에게는 세툭시맙의 치료 효과가 급격히 떨어진다. 그중에서도 KRASG13D 유전자 변이를 가진 환자는 대장암 예후가 특히 나쁘지만, 그동안 연구는 주로 다른 유전자 변이 환자에 집중돼 있어 KRASG13D 대장암 환자를 위한 치료 전략 개발이 시급한 상황이었다. 권 교수 연구팀은 이와 같은 의료 공백을 해소하고자 KRASG13D 대장암의 생물학적 특성을 정밀 분석했다. 분석 결과, 이 암에서 HER2 단백질이 과도하게 만들어지는 것이 약물 반응성이 떨어지는 주요 원인임이 밝혀졌다. 연구팀은 또한 HER2 단백질이 ELF3 전사인자를 자극하고, 이 ELF3가 다시 KRAS 유전자의 발현을 촉진하는 ‘HER2–ELF3–KRAS 축’이 존재한다는 사실을 세계 최초로 밝혀냈으며, 나아가 KRASG13D 변이 대장암은 다른 종류의 암과 달리, HER2와 HER3라는 수용체가 짝을 이루는 작용에 더 의존적으로 증식한다는 점도 입증했다. 연구팀은 이번 독자적인 발견을 통해 단순한 분자 기전 규명에 그치지 않고 실질적인 치료 전략으로의 확장 가능성까지 증명했다. 자체 개발한 단백질-단백질 상호작용 억제 물질 ‘YK1’을 이용해 HER2–ELF3–KRAS 축을 차단하는 실험을 진행했고, 그 결과 기존 치료제인 세툭시맙에 반응하지 않던 KRASG13D 대장암 세포가 다시 치료에 반응하기 시작하는 것을 확인했다. 아울러 동물실험에서도 암의 성장을 효과적으로 억제하는 것을 입증했다. 이번 연구는 특정 유전자 KRASG13D 변이를 가진 대장암에서만 선택적으로 더 활성화되어 있는 신호 전달 체계를 세계 최초로 입증하고 그 축을 겨냥한 표적 치료 전략을 제시했다는 점에서 매우 중요하다. 또한 기존 치료로는 효과를 보지 못했던 환자들에게 맞춤형 치료 전략을 제공하고, 환자의 유전적 특성에 맞춘 정밀 의료 시대를 앞당기는 데 기여하는 학문적 토대를 마련했다는 점에서 그 우수성이 높이 평가된다. 권영주 교수(교신저자), 황수연 박사(제1저자)
- 작성자약학대학
- 작성일2025.06.27
- 조회수1139
-
김광명 교수 연구팀, ACS Nano 학술지에 이식형 광-약물 전달 시스템 기반 뇌종양 치료 연구 게재 최근 뇌종양 분야에서는 광역학 치료(PDT)와 항암화학요법의 병용을 통해 치료 효율을 높이려는 시도가 이어지고 있으나, 혈관 뇌 장벽(BBB)과 두개골로 인한 약물 및 빛의 전달 한계가 여전히 큰 과제로 남아 있다. 기존 치료 방식은 약물의 종양 특이적 축적 부족, 광의 조직 침투 한계, 반복적 투여에 따른 전신 독성 등의 문제를 안고 있었다. 이러한 한계를 극복하기 위해 김광명 교수 연구팀은 이식형 미세 LED 기반의 광·약물 동시 전달 시스템인 LED-SC(optofluidic system)을 개발하였다. 이 장치는 마이크로 주사칩(SC)과 마이크로 LED를 통합하여 뇌종양 중심부에 직접 삽입함으로써 전구약물 나노 입자(PNP)와 광을 종양 조직에 동시에 전달할 수 있도록 설계되었다. PNPs는 광감각제 Verteporfin과 항암제 Doxorubicin을 cathepsin B 효소에 반응하는 펩타이드로 연결한 자가조립형 전구약물로, 종양세포 내에서만 선택적으로 활성화되어 정상 조직에 대한 독성을 최소화한다. 또한, LED-SC를 통해 조사되는 광은 종양 깊숙한 곳까지 도달할 수 있어 기존 광치료의 침투 한계를 극복하였다. 이번 연구 결과는 2025년 4월, 국제 저명 학술지 ACS Nano에 게재되었으며, 마우스 뇌종양 모델에서의 직접적인 약물 전달과 빛 조사를 통해 치료 효능을 입증하였다. 연구에 따르면, 정맥 주사 대비 3.9배 높은 종양 내 약물 축적, 균일한 약물 확산, 종양 내 ROS 생성으로 인한 세포 사멸 등이 관찰되었으며, 결과적으로 종양 크기 12배 감소, 정상 뇌조직 손상 최소화, 생존율 개선 등의 우수한 치료 성과를 보였다. 이 연구는 뇌 종양에서의 기존 광역학치료의 한계를 극복하고, 이식형 장치를 통한 정밀 약물 및 광 치료의 가능성을 제시한 중요한 성과로 평가된다. 김광명 교수 연구팀의 이번 연구는 향후 정밀 뇌종양 치료 및 차세대 광-약물 병용 요법의 새로운 패러다임을 제시할 수 있을 것으로 기대된다.
- 작성자약학대학 관리자
- 작성일2025.05.12
- 조회수1594